Innhold
- Dosering
- Foreskrivende anbefalinger
- Vanlige bivirkninger
- Narkotikahandel
- Kontraindikasjoner og betraktninger
Harvoni ble godkjent 10. oktober 2014 av U.S. Food and Drug Administration (FDA) for bruk hos voksne 18 år eller eldre med HCV-genotype 1-infeksjon, inkludert de med skrumplever.
Harvoni er godkjent for bruk hos tidligere ubehandlede ("behandlingsnaive") pasienter, så vel som de med delvis eller ingen respons på tidligere HCV-behandling ("behandlingserfarne").
Harvoni er det første FDA-godkjente HCV-legemidlet som ikke trenger å tas med verken pegylert interferon (peg-interferon) eller ribavirin (to legemidler som tradisjonelt brukes til HCV-kombinasjonsbehandling, som begge hadde høy toksisitetsprofiler).
Harvoni er rapportert å ha en kurrate på mellom 94% og 99%, mens fase II-studier har rapportert en 100% kurrate hos pasienter som er smittet med HIV og HCV.
Dosering
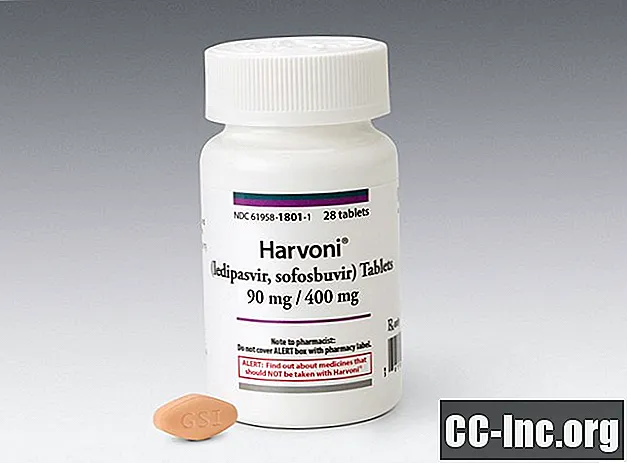
Én tablett (90 mg / 400 mg) tatt daglig med eller uten mat. Harvoni tabletter er diamantformede, ingefærfargede og filmdrasjerte, med "GSI" preget på den ene siden og "7985" på den andre.
Foreskrivende anbefalinger
Harvoni er foreskrevet over et 12- til 24-ukers kurs, i henhold til følgende anbefalinger:
- Behandlingsnaiv med eller uten skrumplever: 12 uker
- Behandlingserfaring uten skrumplever: 12 uker
- Behandlingserfaring med skrumplever: 24 uker
I tillegg kan et 8-ukers kurs vurderes for behandlingsnaive pasienter uten skrumplever som har en HCV-virusbelastning på under 6 millioner eksemplarer / ml.
Vanlige bivirkninger
De vanligste bivirkningene forbundet med bruk av Harvoni (forekommer hos 10% eller færre av pasientene) er:
- Utmattelse
- Hodepine
Andre mulige bivirkninger (under 10%) inkluderer kvalme, diaré og søvnløshet.
Narkotikahandel
Følgende bør også unngås når du bruker Harvoni:
- Rifampin-baserte medisiner mot tuberkulose: Mycobutin, Rifater, Rifamate, Rimactane, Rifadin, Priftin
- Antikonvulsiva midler: Tegretol, Dilantin, Trileptal, fenobarbital
- Aptivus (tipranavir / ritonavir) brukt i HIV antiretroviral terapi
- Johannesurt
Kontraindikasjoner og betraktninger
Det er ingen kontraindikasjoner for bruk av Harvoni hos pasienter med HCV genotype 1.
Imidlertid bør pasienter med HIV som bruker legemidlet tenofovir (inkludert Viread, Truvada, Atripla, Complera, Stribild), være ekstra forsiktige med å overvåke eventuelle tenofovirassosierte bivirkninger, spesielt nedsatt nyrefunksjon (nyre).
Antacida bør tas separat 4 timer før eller etter en Harvoni-dose, mens doser av protonpumpehemmere og H2-reseptorhemmere (aka H2-blokkere) kan trenge å reduseres for å forhindre redusert absorpsjon av ledipasvir.
Selv om det ikke er kontraindikasjon for bruk av Harvoni under graviditet, er det lite kliniske data fra mennesker tilgjengelig. Dyrestudier med bruk av både ledipasvir og sofosbuvir har imidlertid ikke vist noen effekt på fosterutviklingen. Spesialkonsultasjon anbefales under graviditet for å vurdere hvor presserende Harvoni-behandlingen er, spesielt om du skal starte umiddelbart eller vente til etter fødselen.
Det anbefales at alle kvinner i fertil alder overvåkes månedlig for graviditet i løpet av behandlingen. Det anbefales også at pasienten og hennes mannlige partner får minst to ikke-hormonelle prevensjonsmetoder, og at de brukes i løpet av behandlingen og i seks måneder etterpå.
Hepatitt C Doctor Diskusjonsveiledning
Få vår utskrivbare guide for din neste legeavtale for å hjelpe deg med å stille de riktige spørsmålene.

- Dele
- Vend
- E-post
- Tekst