Innhold
Lungeadenokarsinom er en form for ikke-småcellet lungekreft (NSCLC), den vanligste typen lungekreft. NSCLCs står for 80% av lungekreft og av disse er omtrent 50% adenokarsinomer. I dag er adenokarsinom den vanligste formen for lungekreft hos kvinner, asiater og personer under 45 år, og kan til og med påvirke ikke-røykere som har aldri røkt en sigarett.Mens frekvensen av adenokarsinom har vært synkende hos menn og avtatt hos kvinner, fortsetter antallet å øke hos unge, røykfrie kvinner og forskere er ikke helt sikre på hvorfor. Det antas i stor grad at genetikk, passiv røyking og eksponering for radon i hjemmet er alle medvirkende faktorer. Dessverre mangler forskning på mulige årsaker, sannsynligvis delvis på grunn av det faktum at lungekreft i stor grad blir ansett som en "røyksykdom."
Hvorfor lungekreft øker hos aldri røykere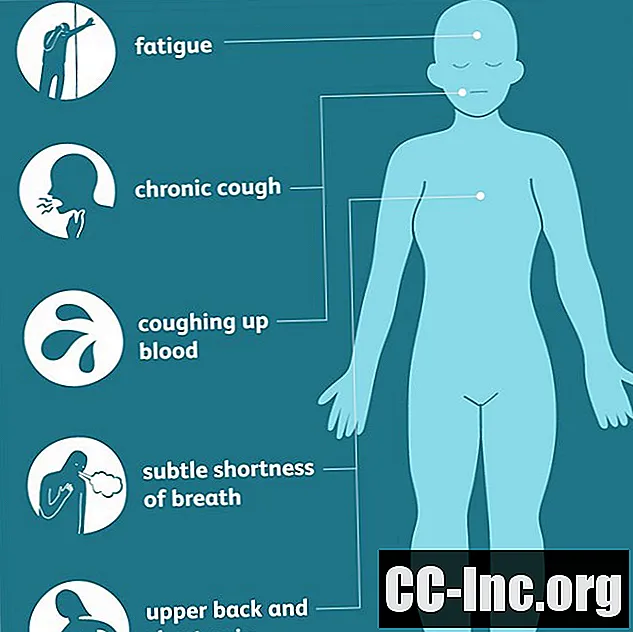
Symptomer på lungeadenokarsinom
Lungeadenokarsinomer begynner vanligvis i vev nær den ytre delen av lungene og kan være der lenge før symptomene dukker opp. Når de endelig dukker opp, er tegnene ofte mindre tydelige enn andre former for lungekreft, og manifesterer seg med kronisk hoste og blodig sputum bare i senere, mer avanserte stadier av sykdommen.
På grunn av dette kan noen av de mer generaliserte tidlige symptomene (som tretthet, subtil kortpustethet eller smerter i øvre rygg og bryst) bli savnet eller tilskrives andre årsaker. Som et resultat blir diagnoser ofte forsinket, spesielt blant unge mennesker og ikke-røykere som kanskje aldri har ansett kreft som en mulighet eller en trussel.
Symptomer på lungekreft hos ikke-røykereFører til
Som med alle kreftformer, er årsaken til lungeadenokarsinom stort sett ukjent. Forskning antyder sterkt at genetiske, miljømessige og livsstilsfaktorer spiller en rolle i sykdomsutbruddet, risikoen og alvorlighetsgraden.
Genetikk
Som en av tre undertyper av NSCLC, antas lungeadenokarsinom å være assosiert med visse genetiske mutasjoner som kan disponere en person for sykdommen.
Disse inkluderer en mutasjon av epidermal growth factor receptor (EGFR) genet, som gir kroppen instruksjoner om hvordan man lager strukturelle proteiner og regulerer hastigheten som det oppstår. Det er minst 10 kjente mutasjoner som kan påvirke genet og få celler til å replikere unormalt og utenfor kontroll.
EGFR-mutasjoner er oftere assosiert med mindre aggressive adenokarsinomer med lav til middels grad.
Andre mutasjoner assosiert med lungeadenokarsinom inkluderer de som påvirker Kirsten rottsarkom (KRAS) genet. I likhet med EGFR regulerer KRAS også cellevekst, modning og død; mutasjoner er sett i 20% til 40% av lungeadenokarsinom tilfeller.
Imidlertid har personer som har svulster KRAS-mutasjoner vanligvis dårlig prognose. Selv om kreften reagerer godt på innledende cellegift, kommer sykdommen nesten alltid tilbake.
Adenokarsinomassosierte mutasjoner overføres noen ganger fra foreldre til barn. En gjennomgang i 2017 i tidsskriftet Onkologibrev antyder at det å ha foreldre eller søsken med lungekreft øker risikoen for sykdommen med 50% sammenlignet med personer uten familiehistorie.
Andre mutasjoner kan forekomme spontant; forskere er usikre på hvorfor.
Helseproblemer og livsstil
Genetikk spiller bare en rolle i risikoen for lungeadenokarsinom. Andre faktorer bidrar betydelig, ikke minst tobakkrøyking.
I følge den langvarige sykepleiernes helsestudie er det mer enn dobbelt så sannsynlig at personer som har røkt i 30 til 40 år, utvikler lungeadenokarsinom enn de som aldri har røkt. Risikoen blir ytterligere doblet hvis du røykte i mer enn 40 år.
Bruk av røyk eksponering øker også risikoen.
Andre faktorer som setter deg i fare for lungeadenokarsinom inkluderer:
- Luftforurensning, inkludert sot og eksos
- Radoneksponering i hjemmet
- Yrkesmessig eksponering for kreftfremkallende stoffer som asbest eller arsen
- En historie med lungesykdom, inkludert kronisk obstruktiv lungesykdom (KOLS) og alvorlig tuberkulose (TB)
Disse og andre røykfrie relaterte risikofaktorer står for hvorfor 20% av lungekreft forekommer hos mennesker som aldri har røkt en sigarett i livet.
Årsaker og risikofaktorer for ikke-småcellet lungekreftDiagnose
Lungekreft oppdages ofte først når abnormiteter blir sett på en røntgen, vanligvis i form av en dårlig definert skygge. Mens det er bekymringsfullt, finner funnet i det minste muligheten for tidlig diagnose.
I så mange som 25% av lungekrefttilfellene vil ikke røntgen på brystet oppdage uregelmessigheter og gi en perfekt "normal" diagnose.
Hvis det er mistanke om kreft, kan annen, mer sensitiv diagnostikk brukes, inkludert:
- Datortomografi (CT-skanning), en brystskanning som kan oppdage mye mindre abnormiteter enn røntgen av brystet
- Magnetisk resonansavbildning (MR), som bruker magnetiske felt til å gjengi bilder
- Bronkoskopi, en prosedyre der et fleksibelt omfang settes inn i halsen for en visuell undersøkelse av de store luftveiene i lungene
- Positron-utslippstomografi (PET-skanning), som kan visualisere områder med metabolsk hyperaktivitet (som kan skje med kreftceller)
Hvis det er dvelende bekymringer etter røntgen av brystet, bør slike ytterligere studier bestilles.
Sputumcytologi, der en prøve av hostet opp spytt og slim blir evaluert, kan også brukes, men dette anses å være mindre nyttig ved diagnostisering av tidlig kreft.
Avhengig av resultatene, kan det hende at legen din ønsker å skaffe en prøve av lungevev for å bekrefte diagnosen. I tillegg til mer invasive biopsier i lungevev, kan en nyere blodprøve kalt flytende biopsi være i stand til å følge spesifikke genetiske abnormiteter i lungekreftceller som EGFR-mutasjoner.
Hvordan diagnostisert ikke-småcellet lungekreftGenetisk profilering
En av de mer spennende fremskrittene innen onkologi har vært bruk av genetisk testing for å profilere kreftceller. Ved å gjøre dette kan leger velge behandlinger som er i stand til å målrette mot de spesifikke genetiske variasjonene.
Nåværende retningslinjer anbefaler at alle personer med avansert lungeadenokarsinom får utført PD-L1 immunhistokjemi (PH-L1 IHC). Denne genetiske testen profilerer kreft og hjelper til med å forutsi den potensielle effektiviteten til et av fire immunterapi-medisiner som er godkjent for behandling av sykdommen.
Når det er sagt, er PD-L1-testing langt fra perfekt når det gjelder å forutsi hvem som vil eller ikke vil svare på disse stoffene. Andre tester, for eksempel tumormutasjonsbyrde (antall mutasjoner som er tilstede i en svulst), kan bidra til å identifisere hvem som vil ha størst nytte av disse nyere målrettede terapiene.
Gjennomgang av molekylære og PD-L1-tester er et av de viktigste trinnene når de først diagnostiseres med avansert lungeadenokarsinom. Spesifikke behandlinger er ikke bare tilgjengelige for de med EGFR-mutasjoner, men andre behandlingsmutasjoner som BRAF, ERBB2, ALK-omorganisering, ROS1 omlegginger og andre.
En oversikt over genetisk testing for lungekreftKreft iscenesettelse
Når en kreftdiagnose er bekreftet, vil legen iscenesette sykdommen basert på en serie standardtester. Målet med iscenesettelse er å bestemme hvor avansert lungekreft er og i hvilken grad den har spredt seg (metastasert).
Staging hjelper direkte behandling på en mer hensiktsmessig måte, slik at en malignitet verken er underbehandlet (påvirker utfall) eller overbehandles (forårsaker unødvendige bivirkninger).
Hvis en sak blir vurdert okkult lungekreft, betyr det at kreftceller finnes i sputum, men en lungesvulst kan ikke bli funnet ved bildestudier. Fase 0 betyr at kreften er begrenset til slimhinnen i luftveiene og ennå ikke er invasiv.
Utover det er det fire trinn som er definert som følger. Disse begrepene vil bli brukt når vi diskuterer behandlingsalternativer.
| Klassifisering | Tilsvarende scene (r) | Behandlingsalternativer |
|---|---|---|
| Tidlig stadium lungekreft | • Trinn 1: Lokalisert og ikke spredt til lymfeknuter • Trinn 2: Spre seg til lymfeknuter, slimhinnen i lungene eller deres viktigste passasjer | Potensielt herdbar med kirurgi |
| Lokalt avansert lungekreft | Trinn 3A: Spre seg til lymfeknuter på samme side av kroppen som svulsten, men ikke fjerne regioner | Kirurgi mulig; adjuvant behandling med cellegift og strålebehandling vanligvis nødvendig |
| Avansert lungekreft | • Trinn 3B: Spre seg til fjerne lymfeknuter eller invasjon av andre strukturer i brystet • Trinn 4: Spre seg til den andre lungen, en annen kroppsdel eller væsken rundt lungen eller hjertet | Ikke-kirurgiske behandlinger er best. Alle, bortsett fra noen sjeldne tilfeller, anses å være ubrukelige. |
En oversikt over lungekreftstadierBehandling
Avhengig av sykdomsstadiet, kan behandlingen omfatte en behandling eller en kombinasjon.
- Kirurgi kan tilbys i de tidlige stadiene, enten alene eller ledsaget av cellegift og / eller strålebehandling. Når det lykkes, gir kirurgi den beste sjansen for å kurere lungekreft.
- Cellegift kan brukes alene, i forbindelse med strålebehandling, eller før eller etter operasjonen.
- Målrettede terapier angripe spesifikke genetiske mutasjoner ved å gjenkjenne spesifikke proteiner på kreftceller og blokkere deres replikasjonsevne. Alternativene inkluderer Tarceva (erlotinib), Iressa (gefitinib), Gilotrif (afatinib), Xalkori (crizotinib), Zykadia (ceritinib), Alecnensa (alectinib) og Tagrisso (osimertinib). Flere er under klinisk undersøkelse.
- Strålebehandling kan brukes enten til å behandle kreft eller kontrollere symptomer hos de med metastatisk kreft. Mer målrettede former for stråling (stereotaktisk kroppsstrålebehandling (SBRT), protonbehandling) kan brukes til mindre kreftformer som kirurgi ikke kan nå. SBRT brukes nå også til å behandle hjernemetastaser og andre metastaser hos personer med lungekreft hvis bare noen få er til stede.
- Immunterapi har som mål å utnytte kroppens immunsystem for å bekjempe kreft. Nåværende alternativer inkluderer Opdivo (nivolumab), Keytruda (pembrolizumab), Tecentriq (atezolizumab) og Imfinzi (durvalumab) for lungekreft i trinn 3 og 4.
Målrettede terapier er langt mindre generaliserte enn tidligere generasjons behandlinger som angrep både sunne og usunne celler, noe som resulterte i alvorlige og til og med utålelige bivirkninger. Kliniske studier er i ferd med å identifisere mer vanlige mutasjoner som kan målrettes mot medisiner. Dette behandlingsområdet er fortsatt i sin spede begynnelse og utvikler seg raskt.
Kliniske studier av målrettede og andre terapier gir håp til dem der godkjente behandlinger enten har mislyktes eller forårsaket alvorlige bivirkninger. NCI anbefaler at personer med lungekreft vurderer å delta i en klinisk prøve.
Tidligere var sannsynligheten for at en klinisk studie ville utgjøre en forskjell for en person med kreft liten, men dette endres raskt etter hvert som spesifikke mål i veien for kreftcelledeling identifiseres. Mange mennesker med stadium 4 lungekreft lever bare på grunn av deres deltakelse i en klinisk prøve.
Til slutt, mange leger anbefaler å få en ny mening fra en annen spesialist eller en av National Cancer Institute (NCI) -designede behandlingssentre som er aktivt involvert i lungekreftforskning. Å gjøre det kan bidra til at du får den mest oppdaterte behandlingsinformasjonen og er bedre i stand til å ta et informert valg.
Hvordan ikke-småcellet lungekreft behandlesEt ord fra veldig bra
Fordi de tidlige symptomene på lungekreft ofte er vanskelige å oppdage, er den gjennomsnittlige overlevelsesgraden på fem år bare rundt 18%. For de som er diagnostisert i de tidlige stadiene, er utsiktene langt mer lovende.
Hva dette fremhever er behovet for større bevissthet om de uspesifikke eller atypiske symptomene på lungekreft. På egen hånd kan symptomene være lette å savne. Sammen kan de heve et rødt flagg som kan føre til tidlig diagnose og tidligere, mer effektiv behandling.
10 beste kreftsykehus i USA