Innhold
- Arvelig brystkreft
- Genmutasjoner som ikke er BRCA
- Brystkreft og genetisk testing
- Støtte for arvelig brystkreft
I tillegg til BRCA1- og BRCA2-genmutasjoner, inkluderer noen av disse mutasjoner i ATM, PALB2, PTEN, CDH1, CHEK2, TP53, STK11, PMS2 og mer. La oss se på hvor viktige disse ikke-BRCA1 / BRCA2-mutasjonene er i familiær brystkreft, og noen av egenskapene til de som ofte finnes.
Arvelig brystkreft
Det antas for tiden at 5 prosent til 10 prosent av brystkreft er genetisk eller familiær (selv om dette tallet kan endres etter hvert som vi lærer mer), men ikke alle disse kreftene skyldes BRCA-mutasjoner.
På det meste testes arvelig brystkreft 29 prosent (og sannsynligvis mye færre) positive for BRCA1- eller BRCA2-genmutasjoner, og mange mennesker prøver å teste for andre kjente genetiske endringer.
Siden vitenskapen bak arvelig kreft er veldig angstløs, for ikke å snakke om forvirrende og ufullstendig, er det nyttig å begynne med å snakke om biologien til genmutasjoner, og hvordan disse endringene i DNA spiller en rolle i utviklingen av kreft.
Arvet mot ervervet genmutasjoner
Når vi snakker om mutasjoner, er det viktig å skille mellom arvelige og ervervede genmutasjoner.
Ervervede eller somatiske genmutasjoner har fått mye oppmerksomhet de siste årene, da disse mutasjonene forårsaker endringer som driver veksten av kreft. Målrettede terapier, medisiner som er målrettet mot spesifikke veier relatert til disse endringene, har forbedret behandlingen av noen kreftformer, for eksempel lungekreft.
Ervervede mutasjoner er imidlertid ikke til stede fra fødselen, men blir dannet når som helst etter fødselen i ferd med å bli en celle til en kreftcelle. Disse mutasjonene påvirker bare noen celler i kroppen. De arves ikke fra en forelder, men heller "ervervet" ettersom DNA i celler utsettes for skade fra miljøet eller som et resultat av kroppens normale metabolske prosesser.
Arvelige, eller kimlinjemutasjoner, derimot, er genetiske endringer som mennesker er født med, og som overføres fra en eller begge foreldrene. Disse mutasjonene påvirker alle kroppens celler. Det er disse arvelige mutasjonene (og andre genetiske endringer) som kan øke sjansen for at en person vil utvikle kreft, og redegjøre for det som er kjent som arvelig eller familiær brystkreft.
Arvelige (germline) vs. ervervet (somatiske) genmutasjonerHvordan øker arvelige genmutasjoner kreftrisiko?
Mange lurer på hvordan nøyaktig et unormalt gen eller kombinasjoner av gener kan føre til brystkreft, og en kort diskusjon av biologien er nyttig for å forstå mange av spørsmålene, for eksempel hvorfor ikke alle som har disse mutasjonene utvikler kreft.
Vårt DNA er en blåkopi eller kode som brukes til å produsere proteiner. Når kartet eller koden er feil (for eksempel "bokstaver" i et bestemt gen), gir det feil retninger for å syntetisere et protein. Det unormale proteinet klarer da ikke å utføre sin vanlige jobb. Ikke alle genmutasjoner øker risikoen for kreft, og faktisk gjør de fleste ikke det. Mutasjoner i gener som er ansvarlige for vekst og deling av celler, eller "driver mutasjoner" er det som driver veksten av kreft. Det er to hovedtyper av gener som, når de muteres, kan føre til ukontrollert vekst kjent som kreft: onkogener og tumorundertrykkende gener.
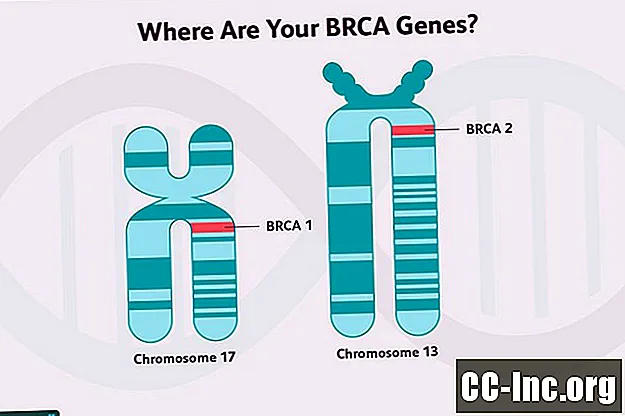
Flere av genene assosiert med høyere risiko for brystkreft er tumorundertrykkende gener. Disse genene koder for proteiner som fungerer for å reparere skade på DNA i celler (skade fra giftstoffer i miljøet eller normale metabolske prosesser i celler), tjener til å eliminere celler som ikke kan repareres, eller regulere vekst på andre måter. Genene BRCA1 og BRCA2 er tumorundertrykkende gener.
Mange av disse genene er autosomal recessive, noe som betyr at hver person arver en kopi av genet fra hver av foreldrene, og begge kopiene må muteres for å øke kreftrisikoen. Forenklet betyr dette at en kombinasjon av genetiske og miljømessige faktorer (en ervervet mutasjon i det andre genet) må handle sammen for å resultere i at kreft utvikler seg. I tillegg til dette må vanligvis flere mutasjoner forekomme for at en celle skal bli en kreftcelle.
Hva det betyr å ha en genetisk disposisjon for kreftGjennomtrengning
Ikke alle genmutasjoner eller genetiske endringer øker risikoen for brystkreft i samme grad, og dette er et viktig konsept for alle som vurderer genetisk testing, spesielt ettersom mange mennesker har hørt om den svært høye risikoen BRCA-mutasjoner gir. Gjennomtrengning er definert som andelen mennesker med en mutasjon som vil oppleve tilstanden (i dette tilfellet utvikle brystkreft).
For noen mutasjoner er risikoen for brystkreft veldig høy. For andre kan risikoen bare økes med en faktor på 1,5. Dette er viktig å forstå når vi snakker om mulige forebyggende alternativer.
Epigenetikk
Et annet viktig begrep som er viktig for å forstå genetikk og kreft, men for komplisert til å utforske i detalj her, er epigenetikk. Vi har lært at endringer i DNA som ikke involverer endringer i baseparene (nukleotidene) eller "bokstavene" som koder for et protein, kan være like viktige i utviklingen av kreft. Med andre ord, i stedet for strukturelle endringer i ryggraden i DNA, kan det være molekylære endringer som endrer hvordan meldingen blir lest eller uttrykt.
Genmutasjoner som ikke er BRCA
BRCA-genmutasjoner er den mest kjente genetiske abnormiteten forbundet med brystkreft, men det har vært klart at det er kvinner som er disponert for brystkreft basert på familiehistorie, som tester negativt.
En studie fra 2017 fant at BRCA-mutasjoner bare utgjorde 9 prosent til 29 prosent av arvelige brystkreft. Selv når testingen ble gjort for ytterligere 20 til 40 kjente mutasjoner, testet imidlertid bare 4 prosent til 11 prosent av kvinnene positive. Med andre ord, 64 prosent til 86 prosent av kvinnene mistenkt for å ha arvelig brystkreft testet negativt for både BRCA-mutasjoner og 20 til 40 andre.
Ikke-BRCA1 / BRCA2 familiær brystkreft
Vår kunnskap om genmutasjoner som øker risikoen for brystkreft er fortsatt ufullstendig, men vi vet nå at det er minst 72 genmutasjoner knyttet til arvelig brystkreft. Disse mutasjonene (og andre som ennå ikke er oppdaget) antas å være ansvarlige for de 70 til 90 prosent av arvelige brystkreftene som tester negativt for BRCA-genmutasjoner. Forkortelsen BRCAX er blitt laget for å beskrive disse andre mutasjonene, og står for ikke- BRCA1 BRCA2-relatert familiær brystkreft.
72 Genetiske mutasjoner knyttet til arvelig brystkreftDe genetiske abnormitetene nedenfor er forskjellige i frekvens, mengde risiko assosiert, type brystkreft de er knyttet til, og andre kreftformer forbundet med mutasjonene.
De fleste av disse brystkreftene er like karakteristiske (som krefttype, østrogenreseptorstatus og HER2-status) som ikke-arvelige eller sporadiske brystkreftformer, men det er unntak. For eksempel er noen mutasjoner sterkere assosiert med trippel negativ brystkreft, inkludert mutasjoner i BARD1, BRCA1, BRCA2, PALB2, ogRAD51D.
Variasjon innen mutasjoner
Ikke alle mennesker som har følgende genmutasjoner er de samme. Generelt kan det være hundrevis av måter disse genene muteres på. I noen tilfeller vil genet produsere proteiner som undertrykker tumorvekst, men proteinene vil ikke fungere like godt som det normale proteinet. Med andre mutasjoner kan det hende at proteinet ikke blir produsert i det hele tatt.
BRCA (En kort gjennomgang for sammenligning)
BRCA 1-genmutasjoner og BRCA2-genmutasjoner er begge assosiert med en økt risiko for å utvikle brystkreft, så vel som noen andre kreftformer, selv om de to skiller seg noe ut i den risikoen.
I gjennomsnitt vil 72 prosent av kvinnene som har BRCA1-mutasjoner og 69 prosent som har muterte BRCA2-gener, utvikle brystkreft innen 80 år.
I tillegg kan brystkreft forbundet med disse mutasjonene variere. Brystkreft hos kvinner som har BRCA1-mutasjoner er mer sannsynlig å være trippel negativ. Rundt 75 prosent er østrogenreseptor-negative, og de er også mindre sannsynlige å være HER2-positive. Det er også mer sannsynlig at de har høyere svulstgrad. Brystkreft hos kvinner med BRCA2-mutasjoner, derimot, ligner kreft hos kvinner som ikke er BRCA-genmutasjonsbærere.
ATM-gen (ATM-serin / treoninkinase)
ATM-genet koder for proteiner som hjelper med å kontrollere cellens veksthastighet. De hjelper også til å reparere skadede celler (celler som har påført DNA-skade fra giftstoffer) ved å aktivere enzymer som reparerer denne skaden.
De som har to kopier av det muterte genet har et uvanlig autosomalt recessivt syndrom kjent som ataksi-telangiektasi. Med ataksi-telangiektasi øker de defekte proteinene ikke bare risikoen for kreft, men fører til at noen celler i hjernen dør av for tidlig, noe som resulterer i en progressiv nevrodegenerativ lidelse.
Mennesker som bare har en mutert kopi av genet (omtrent 1 prosent av befolkningen) har 20 til 60 prosent livstidsrisiko for å utvikle brystkreft.
Mennesker som har denne mutasjonen antas å være disponert for brystkreft i tidlig alder, samt å utvikle bilateral brystkreft.
Det anbefales å undersøke brystkreft med bryst-MR fra 40 år, og kvinner vil kanskje vurdere forebyggende mastektomi. Personer med ett mutert minibankgen ser ut til å være utsatt for kreft i skjoldbruskkjertelen og bukspyttkjertelen og er mer følsomme for stråling.
PALB2
Mutasjoner i PALB2-genet er også en viktig årsak til arvelig brystkreft. Genet PALB2 koder for et protein som fungerer sammen med BRCA2-proteinet for å reparere skadet DNA i celler. Samlet sett er livstidsrisikoen for brystkreft med en PALB2-mutasjon så høy som 58 prosent, selv om dette kan variere etter alder. Risikoen er 8 til 9 ganger gjennomsnitt for kvinner under 40 år, men rundt 5 ganger gjennomsnitt for kvinner over 60 år.
Blant de som bærer en kopi av genet, vil 14 prosent utvikle brystkreft i alderen 50 og 35 prosent innen 70 år (mindre enn ved BRCA-mutasjoner).
Personer som har en PALB2-mutasjon og utvikler brystkreft, kan ha høyere risiko for å dø av sykdommen.
Mennesker som arver 2 kopier av det muterte PALB2-genet, har en type Fanconi-anemi preget av svært lave antall røde blodlegemer, hvite blodlegemer og blodplater.
CHEK2
CHEK2-genet koder for et protein som aktiveres når DNA-skader oppstår. Det aktiverer også andre gener som er involvert i reparasjon av celler.
Livstidsrisikoen for bærere av avkuttende mutasjoner av CHEK2 er 20 prosent for en kvinne uten berørt slektning, 28 prosent for en kvinne med en annengrads pårørende, 34 prosent for en kvinne med en førstegradsrelatert, og 44 prosent for en kvinne med både en første- og andregrads pårørende.
For både menn og kvinner øker genet også risikoen for tykktarmskreft og ikke-Hodgkins lymfom.
CDH1
Mutasjoner i CDH1 forårsaker en tilstand kjent som arvelig gastrisk kreftsyndrom.
Mennesker som arver dette genet har en livstidsrisiko på opptil 80 prosent for å utvikle magekreft, og opptil 52 prosent for å utvikle lobulær brystkreft.
Genet koder for et protein (epitelkadherin) som hjelper celler til å holde seg til hverandre (en av forskjellene mellom kreftceller og normale celler er at kreftceller mangler disse vedheftskemikaliene som får dem til å feste seg). Kreft hos mennesker som arver denne mutasjonen, er mer sannsynlig å metastasere.
PTEN
Mutasjoner i PTEN-genet er en av de mer vanlige tumorundertrykkelsesgenmutasjonene. Genet koder for proteiner som regulerer cellers vekst, og hjelper også celler med å holde sammen.
Mutasjoner i genet ser ut til å øke risikoen for at kreftceller bryter av fra en svulst og metastaserer. PTEN er assosiert med et syndrom som kalles PTEN hamartom tumor tumor samt Cowden syndrom.
Kvinner som bærer en PTEN-mutasjon har en livstidsrisiko for å utvikle brystkreft opptil 85 prosent, og har også økt risiko for godartede brystendringer som fibrocystisk sykdom, adenose og intraduktal papillomatose.
Mutasjonene er også knyttet til økt risiko for livmorkreft (og godartede livmorfibroider), skjoldbruskkjertelkreft, tykktarmskreft, melanom og prostatakreft.
Ikke-kreftrelaterte symptomer inkluderer stor hodestørrelse (makrocefali) og tendensen til å danne godartede svulster kjent som hamartomer.
STK11
Mutasjoner i STK11 er assosiert med en genetisk tilstand kjent som Peutz-Jegher syndrom. STK11 er et tumorundertrykkende gen involvert i cellevekst.
I tillegg til økt risiko for brystkreft (med en livstidsrisiko på opptil 50 prosent), har syndromet en økt risiko for mange kreftformer, hvorav noen inkluderer tykktarmskreft, kreft i bukspyttkjertelen, magekreft, eggstokkreft, lungekreft, livmorkreft, og mer.
Ikke-kreftrelaterte tilstander assosiert med mutasjonen inkluderer ikke-kreft polypper i fordøyelseskanalen og urinveiene, fregner i ansiktet og innsiden av munnen og mer. Screening av brystkreft anbefales ofte for kvinner som begynner i 20-årene, og ofte med MR med eller uten mammogrammer.
TP53
TP53-genet koder for proteiner som stopper veksten av unormale celler.
Disse mutasjonene er ekstremt vanlige i kreft, med ervervet mutasjoner i p53-genet blir funnet i rundt 50 prosent av kreftformene.
Arvelige mutasjoner er mindre vanlige og assosiert med tilstander kjent som Li-Fraumeni syndrom, eller Li-Fraumeni-lignende syndrom (som har lavere kreftrisiko). Flertallet av mennesker som arver mutasjonen, utvikler kreft i en alder av 60 år, og i tillegg til brystkreft, er de tilbøyelige til å utvikle beinkreft, binyrekreft, kreft i bukspyttkjertelen, tykktarmskreft, leverkreft, hjernesvulster, leukemi og mer. Det er ikke uvanlig at mennesker med mutasjonen utvikler mer enn en primær kreft.
Arvede mutasjoner i p53-genet antas å utgjøre rundt 1 prosent av tilfellene av arvelig brystkreft. Brystkreft assosiert med mutasjonen er ofte HER2-positive og har høy tumorgrad.
Lynch syndrom
Lynch syndrom eller arvelig ikke-polypose kolorektal kreft er assosiert med mutasjoner i flere forskjellige gener, inkludert PMS2, MLH1, MSH2, MSH6 og EPCAM.
Spesielt PMS2 har vært assosiert med dobbelt så stor risiko for brystkreft. Genet fungerer som et tumorundertrykkende gen, som koder for et protein som reparerer skadet DNA.
I tillegg til brystkreft har disse mutasjonene en høy risiko for kreft i tykktarm, eggstokk, livmor, mage, lever, galleblære, tynntarm, nyre og hjerne.
Andre mutasjoner
Det er flere andre genmutasjoner assosiert med økt risiko for å utvikle brystkreft, og det forventes at flere vil bli oppdaget i nær fremtid. Noen av disse inkluderer:
- BRIP1
- BARD1
- MRE11A
- NBN
- RAD50
- RAD51C
- SEC23B
- BLM
- MUTYH
Brystkreft og genetisk testing
På det nåværende tidspunkt er det tilgjengelig testing for BRCA-genmutasjoner, samt mutasjoner ATM, CDH1, CHEK2, MRE11A, MSH6, NBN, PALB2, PMS2, PTEN, RAD50, RAD51C, SEC23B og TP53, med dette området forventet å utvides dramatisk i nær fremtid.
Å ha disse testene tilgjengelige reiser imidlertid mange spørsmål. Hvem kan for eksempel ha arvelig brystkreft, og hvem bør testes? Hva bør du gjøre hvis du tester positivt for et av disse genene?
Ideelt sett bør enhver testing bare gjøres med veiledning og hjelp fra en genetisk rådgiver. Det er to grunner til dette.
Den ene er at det kan være ødeleggende å lære at du har en mutasjon som kan øke risikoen, og veiledningen fra noen som er klar over anbefalt behandling og screening er uvurderlig.
Som nevnt tidligere gir noen mutasjoner høy risiko og andre mye lavere risiko. Noen mutasjoner kan være mer bekymringsfulle tidligere i livet (for eksempel i 20-årene), mens andre kanskje ikke krever tidlig screening. En genetisk rådgiver kan hjelpe deg med å lære om hva som for øyeblikket anbefales med hensyn til screening for din spesielle mutasjon, mens du tar hensyn til andre risikofaktorer du måtte ha.
Den andre grunnen til at genetisk rådgivning er så viktig, er at du kan ha en betydelig risiko for å utvikle brystkreft, selv om testene dine er negative. Det er mye som ikke er å lære, og en genetisk rådgiver kan hjelpe deg med å se på familiehistorien din for å se om du kan ha høy risiko til tross for negativ testing, og planlegge screening deretter.
Genetisk testing for brystkreftStøtte for arvelig brystkreft
Akkurat som folk som har blitt diagnostisert med brystkreft trenger støtte, trenger de som bærer gener som øker risikoen støtte. Heldigvis er det organisasjoner som fokuserer spesielt på å støtte mennesker i denne situasjonen.
Én organisasjon, FORCE, som er et akronym for Facing Our Risk of Cancer Empowered, tilbyr en hjelpelinje, oppslagstavle og informasjon for de som står overfor arvelig kreft.
Andre organisasjoner og støttesamfunn er tilgjengelige for å hjelpe mennesker med å takle beslutningene knyttet til en diagnose av arvelig brystkreft.
Begrepet "previvor" ble laget av FORCE for å beskrive mennesker som overlever en predisposisjon for brystkreft. Hvis dette er situasjonen du står overfor, er du ikke alene, og bruker hashtaggen #previvor, kan du finne mange andre på Twitter og andre sosiale medier.
Et ord fra veldig bra
Det kan være overveldende å lære om de mange forskjellige genmutasjonene som øker risikoen for brystkreft utover BRCA-mutasjoner, men disse "andre" mutasjonene er av betydelig betydning, vel vitende om at BRCA-mutasjoner utgjør et relativt mindretall av familiære brystkreftformer. Samtidig er vitenskapen om arvelig brystkreft fortsatt i sin spede begynnelse, og det er mye å lære. Hvis du er bekymret for at du kan ha en mutasjon eller har lært at du gjør det, er det nyttig å lære så mye du kan. Arvelige kreftorganisasjoner som FORCE kan ikke bare gi deg ytterligere informasjon, men kan hjelpe deg med å få kontakt med andre som står overfor en reise med lignende spørsmål og bekymringer.